[ad_1]
Os conteúdos de Química que mais caem no Enem são misturas e técnicas de separação; forças intermoleculares e polaridade; eletroquímica; estequiometria; termoquímica; Química orgânica; Química inorgânica; Química ambiental; e equilíbrio químico.
Os conteúdos de Química no Enem são abordados dentro da área de Ciências da Natureza e suas Tecnologias, em conjunto com os conteúdos de Física e Biologia, em um conjunto de 45 questões de múltipla escolha.
As questões do Enem são contextualizadas e multidisciplinares, sinalizando que o estudante encontrará questões que envolvem conceitos de diferentes disciplinas, quase sempre aplicados em situações reais.
Veja também: Principais dicas de Química para o Enem
Quais são os conteúdos de Química que mais caem no Enem?
→ Misturas e técnicas de separação
Misturas são sistemas formados por duas ou mais substâncias puras que apresentam propriedades físicas variáveis. As misturas podem ser homogêneas, se apresentam uma única fase, ou heterogêneas, quando mantêm mais de uma fase.
No cotidiano existe uma infinidade de misturas, e, por isso, há a necessidade de técnicas para a separação dessas misturas. A escolha da técnica adequada para a separação de uma mistura dependerá de suas características específicas. Por exemplo, para separar uma mistura homogênea entre sal e água, não faz sentido empregar um método de filtração, porém a destilação ou a evaporação são boas escolhas.
No Enem esse tema pode ser explorado com base em seu uso industrial, farmacêutico, relacionado à obtenção dos derivados do petróleo, ou no tratamento de água e efluentes. Veja como esses assuntos já foram cobrados no Enem a seguir.
(Enem) Em seu laboratório, um técnico em química foi incumbido de tratar um resíduo, evitando seu descarte direto no meio ambiente. Ao encontrar o frasco, observou a seguinte informação: “Resíduo: mistura de acetato de etila e água”.
Considere os dados do acetato de etila:
– Baixa solubilidade em água;
– Massa específica = 0,9 g cm-3;
– Temperatura de fusão = -83°C
– Pressão de vapor maior que a da água.
A fim de tratar o resíduo, recuperando o acetato de etila, o técnico deve
A) evaporar o acetato de etila sem alterar o conteúdo de água.
B) filtrar a mistura utilizando um funil comum e um papel de filtro.
C) realizar uma destilação simples para separar a água do acetato de etila.
D) proceder a uma centrifugação da mistura para remover o acetato de etila.
E) decantar a mistura separando os dois componentes em um funil adequado.
Resolução:
Alternativa E
As propriedades descritas para o acetato de etila indicam que essa substância não é solúvel em água, é menos densa e evapora com mais facilidade do que a água. Em razão da insolubilidade e da diferença de densidade entre as substâncias, a mistura entre elas forma duas fases (água abaixo e acetato de etila acima), sendo possível usar a decantação para separá-las. Para isso, é usado um funil de separação — equipamento de laboratório que possui uma torneira para remover a fração inferior.
Não pare agora… Tem mais depois da publicidade 😉
→ Forças intermoleculares e polaridade
Forças intermoleculares são as forças que atuam para manter as moléculas de uma substância unidas. São responsáveis por diversas propriedades da matéria, como solubilidade, estado físico da matéria e temperaturas de fusão e de ebulição.
O tipo de força intermolecular predominante em cada molécula depende da sua polaridade e da natureza dos átomos envolvidos. Veja como esse tema já foi abordado no Enem a seguir.
(Enem) O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida ocorre a formação de:
A) ligações dissulfeto
B) ligações covalentes
C) ligações de hidrogênio
D) interações dipolo induzido – dipolo induzido
E) interações dipolo permanente – dipolo permanente
Resolução:
Alternativa D
O carvão ativado (C) e o benzeno (C6H6) são compostos formados basicamente por carbono, logo, são moléculas apolares. Compostos apolares interagem entre si por meio de interações do tipo dipolo induzido.
→ Eletroquímica
A eletroquímica é um tema muito recorrente no Enem e é responsável pelo estudo da conversão de energia química em energia elétrica por meio de reações químicas que envolvam a movimentação de elétrons.
Dentro do contexto da eletroquímica, diversos temas podem ser abordados, desde conteúdos mais fundamentais, como reações de oxidação-redução e número de oxidação (NOX), até assuntos mais amplos e contextualizados, incluindo pilhas, eletrólise e corrosão de metais.
Com a atual e urgente necessidade de renovação da matriz energética mundial, questões envolvendo pilhas, baterias, células a combustível e carros elétricos costumam ser abordadas na prova. Veja como esse tema já foi abordado no Enem a seguir.
(Enem) O alumínio é um metal bastante versátil, pois, a partir dele, pode-se confeccionar materiais amplamente utilizados pela sociedade. A obtenção do alumínio ocorre a partir da bauxita, que é purificada e dissolvida em criolita fundida (Na3AlF6) e eletrolisada a cerca de 1000 °C. Há liberação do gás dióxido de carbono (CO2), formado a partir da reação de um dos produtos da eletrólise com o material presente nos eletrodos. O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita. A reação global do processo é:
\(\mathbf{2\ Al_2 O_3\ (l)+3\ C\ (s)⟶4\ Al\ (l)+3\ CO_2\ (g)}\)
Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são:
A) 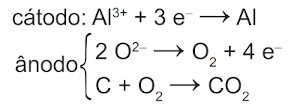
B) 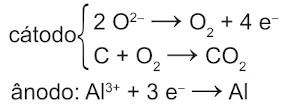
C) 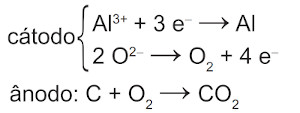
D) 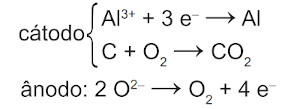
E) 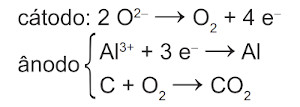
Resolução:
Alternativa A
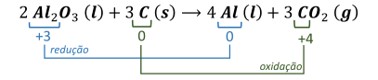
Semirreação de redução: \(\mathbf{Al^{3+}+3e^-⟶Al^0}\) (cátodo)
Semirreação de oxidação: \(\mathbf{C^0⟶C^{4+}+4e^-}\) (ânodo)
A espécie C4+ ocorre sob a forma de CO2, então as reações envolvidas no ânodo são:
\(\mathbf{2 O^{2-}⟶O_2+4e^-}\)
\(\mathbf{C+ O_2⟶CO_2}\)
→ Estequiometria
A estequiometria é o cálculo das quantidades de substâncias envolvidas nas reações químicas, considerando as leis ponderais de conservação de massas e proporcionalidade.
Nesse tema estão incluídos cálculos relativos ao rendimento de reações, determinação da pureza de reagentes e produtos, e considerações sobre excesso de reagentes. É comum também aparecer cálculos envolvendo reações sucessivas. É essencial conhecer sobre a representação das fórmulas químicas.
Esse tema pode ser cobrado em combinação com muitos outros, como termoquímica, eletroquímica e equilíbrio químico. Veja, a seguir, como o Enem já cobrou o tópico de rendimento de reações dentro do tema de estequiometria.
(Enem) O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique “livre” e o enxofre se combine com o O2 produzindo SO2, conforme a equação química:
\(\mathbf{Cu_2 S\ (s)+ O_2 (g) \stackrel{\triangle}{\longrightarrow} 2\ Cu\ (l)+ SO_2\ (g)}\)
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996. (adaptado).
Considerando que se queira obter 16 mols do metal em uma reação cujo rendimento é de 80%, a massa, em gramas, do minério necessária para obtenção do cobre é igual a
A) 955.
B) 1018.
C) 1590.
D) 2035.
E) 3180.
Resolução:
Alternativa C
Nesse exercício, a equação química já está balanceada, mas lembre-se sempre de conferir isso antes de iniciar a resolução.
Pela reação apresentada, 1 mol de Cu2S forma 2 mols de cobre metálico (Cu), considerando uma reação com 100% de rendimento.
\(\mathbf{1\ mol\ Cu_2\ S—2\ mol\ Cu}\)
Como o rendimento real da reação é de 80%, a quantidade de cobre a ser formada, com base em 1 mol de Cu2S, será menor do que 2 mols:
\(\mathbf{2\ mols\ de\ Cu—100\%\ rendimento}\)
\(\mathbf{x—80\%\ rendimento}\)
\(\mathbf{x=1,6\ mol\ de\ Cu}\)
Então, na verdade, 1 mol de Cu2S gera 1,6 mol de cobre metálico, logo, para a obtenção de 16 mols de cobre metálico, a quantidade de minério de cobre é:
\(\mathbf{1\ mols\ de\ Cu_2S—1,6\ mols\ de\ Cu}\)
\(\mathbf{x—16\ mols\ de\ Cu}\)
\(\mathbf{x=10\ mols\ de\ Cu_2S}\)
Considerando a massa molar para o Cu2S (159 g/mol)*, calcula-se a massa de minério cobre necessária:
\(\mathbf{159\ g—1\ mol\ de\ Cu_2S}\)
\(\mathbf{x—10\ mols\ de\ Cu_2S}\)
\(\mathbf{x=1590\ g\ de\ Cu_2S}\)
*É necessário determinar a massa molar do reagente Cu2S, igual a: 159 g/mol ((2 x 63,5) + 32).
→ Termoquímica
A termoquímica trata do calor ou energia envolvidos nas reações químicas e nos processos de mudança de estado físico.
Quando uma reação química precisa absorver energia para acontecer, ela é chamada endotérmica. Quando há liberação de calor durante a reação química, ela é chamada de exotérmica. As medidas de energia desses processos são dadas em termos de variação de entalpia (ΔH), adotando-se o valor de ΔH negativo para processos exotérmicos e ΔH positivo para processos endotérmicos.
A lei de Hess é uma ferramenta importante em termoquímica, pois permite o cálculo de energia envolvida em um processo composto por várias etapas. Veja como esse tema já foi abordado no Enem a seguir.
(Enem) O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico em altas temperaturas, conforme a equação química:
\(\mathbf{3\ C_2 H_2⟶C_6 H_6 }\)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. \(\mathbf{C_2 H_2 (g)+ 5⁄2\ O_2 (g)⟶2\ CO_2 (g)+ H_2 O\ (l)}\), ΔH = -310 kcal/mol
II. \(\mathbf{C_6 H_6 (l)+ 15⁄2\ O_2 (g)⟶6\ CO_2 (g)+ 3\ H_2 O\ (l)}\) = -780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de:
A) -1090
B) -150
C) -50
D) +157
E) +470
Resolução:
Alternativa B
O exercício fornece as reações de combustão do C2H2 e do C6H6. Com base nessas informações, é necessário estimar a variação de entalpia da reação principal de formação do benzeno, para isso, usa-se a lei de Hess.
Para chegar a esse valor, manipulamos as duas reações fornecidas para que elas representem a equação principal, mantendo atenção aos sinais. Então, basta multiplicar a equação I por 3 e inverter a equação II.
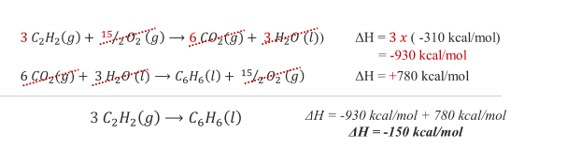
→ Química orgânica
A Química orgânica é a área da Química que se dedica ao estudo dos compostos formados basicamente por carbono. As moléculas formadas por carbono são a base da vida, como conhecemos.
Entre os assuntos de Química orgânica mais cobrados no Enem, estão as funções orgânicas, nomenclatura de compostos orgânicos, reações orgânicas e combustíveis. Considerando as funções orgânicas e a nomenclatura de compostos orgânicos, é importante ter conhecimentos sobre as classificações do carbono, saber reconhecer as funções orgânicas (álcool, cetona, aldeídos, ácido carboxílico, aminas, amidas etc.), e aplicar isso na análise de moléculas biológicas, como carboidratos, lipídios e proteínas. Observe como esses assuntos costumam aparecer nas provas a seguir.
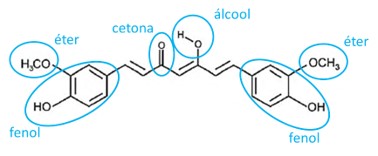
(Enem) A curcumina, substância encontrada no pó amarelo-alaranjado extraído da raiz da cúrcuma ou açafrão-da-índia (Cúrcuma longa), aparentemente, pode ajudar a combater vários tipos de câncer, o mal de Parkinson e o de Alzheimer, e até mesmo retardar o envelhecimento. Usada há quatro milênios por algumas culturas orientais, apenas nos últimos anos passou a ser investigada pela ciência ocidental.
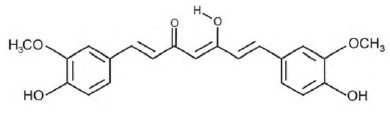
ANTUNES, M. G. L. Neurotoxicidade induzida pelo quimioterápico cisplatina: possíveis efeitos citoprotetores dos antioxidantes da dieta curcumina e coenzima Q10. Pesquisa FAPESP. São Paulo, n. 168, fev. 2010 (adaptado).
Na estrutura da curcumina, identificam-se grupos característicos das funções
A) éter e álcool.
B) éter e fenol.
C) éster e fenol.
D) aldeído e enol.
E) aldeído e éster.
Resolução:
Alternativa B
A imagem abaixo destaca todas as funções orgânicas existentes na molécula da curcumina. Entre os itens apresentados, apenas o item b corresponde a duas das funções orgânicas destacadas na imagem.
→ Química inorgânica
A Química inorgânica se concentra no estudo dos elementos diferentes de carbono e de seus compostos, ou seja, explora a composição, as propriedades e as reações das substâncias ditas “minerais”.
As funções inorgânicas são temas recorrentemente cobrados no Enem, sendo exploradas as características e as reações envolvendo os ácidos, bases, sais e óxidos. Entender as reações inorgânicas (reações de neutralização e reações de hidrólise [ácida, básica e salina]), considerando as fórmulas químicas e o balanceamento de equações, são conhecimentos-chave para ir bem na prova.
As teorias ácido-base, os conceitos de acidez e basicidade, além da escala de pH, são importantes, até mesmo porque são temas facilmente relacionados com outras disciplinas. Veja como isso já foi abordado no Enem a seguir.
(Enem) O ácido sulfúrico (H2SO4) é um dos ácidos mais utilizados em indústrias e em laboratórios. O resíduo ácido gerado pelo seu uso pode provocar sérios danos ao meio ambiente. Em um laboratório, gerou-se uma grande quantidade de resíduo ácido a partir do ácido sulfúrico, o qual necessita ser neutralizado para o seu descarte. O técnico desse laboratório tem à sua disposição cinco substâncias: CaO, K2SO4, NaHSO4, CH3CH2OH e C5H9CONH2.
Qual dessas substâncias é a adequada para realizar esse tratamento?
A) CaO
B) K2SO4
C) NaHSO4
D) CH3CH2OH
E) C5H9CONH2
Resolução:
Alternativa A
Uma reação de neutralização possui como reagentes um ácido e uma base, para que formem sal e água como produtos.
Para neutralizar o resíduo ácido, é necessário então selecionar uma base. Entre as opções apresentadas, quem cumpre o papel de base é o CaO, porque este é um óxido básico, que tem como característica originar uma base quando entra em contato com a água.
\(CaO+ H_2 O ⟶Ca(OH)_2\)
O item C apresenta a substância CH3CH2OH. Mesmo essa molécula possuindo grupo -OH do lado direito, não é uma base, pois se trata de uma molécula orgânica, logo, é um álcool.
→ Química ambiental
Conteúdos relativos à Química ambiental são temas sempre presentes no Enem devido à sua importância e atualidade bem como pela possibilidade de se relacionar aos assuntos abordados em outras disciplinas, como Biologia e Geografia.
Gases de efeito estufa, aquecimento global, mudanças climáticas, combustíveis fósseis, diferentes tipos de poluição, fontes de energia renováveis e ciclos biogeoquímicos são as formas que o Enem costuma cobrar os temas de Química ambiental. As reações inorgânicas costumam aparecer em questões que englobam o efeito de substâncias inorgânicas sobre a atmosfera. Veja como esse tema já foi abordado no Enem a seguir.
(Enem) O solvente tetracloroeteno ou percloroetileno é largamente utilizado na indústria de lavagem a seco e em diversas outras indústrias, tais como a de fabricação de gases refrigerantes. Os vapores desse solvente, quando expostos à elevada temperatura na presença de oxigênio e água, sofrem degradação, produzindo gases poluentes, conforme representado pela equação:
C2Cl4(g) + O2(g) + H2O(g) → 2 HCl(g) + Cl2(g) + CO(g) + CO2(g)
BORGES, L. D.; MACHADO, P. F. L. Lavagem a seco. Química Nova na Escola. n. 1 fev. 2013 (adaptado).
Os produtos dessa degradação, quando lançados no meio ambiente, contribuem para a
A) elevação do pH do solo.
B) formação de chuva ácida.
C) eutrofização de mananciais.
D) elevação dos níveis de ozônio na atmosfera.
E) formação de óxidos de enxofre na atmosfera.
Resolução:
Alternativa B
Os produtos da reação, quando lançados na atmosfera, entram em contato com água, logo, deve-se considerar quais são as substâncias existentes nesse contexto.
Analisando os produtos da reação apresentada, o ácido clorídrico (HCl) libera íons H+ em contato com a água.
\(\mathbf{HCl+ \stackrel{H_2O}{\longrightarrow} H^++Cl^-}\)
Já o dióxido de carbono (CO2), em contato com a água, forma o ácido carbônico (H2CO3), uma espécie instável, e acaba se decompondo em íons H+ e íons bicarbonato (HCO3–).
\(\mathbf{CO_2+ H_2 O⟶H_2 CO_3⟶ H^++HCO_3^-}\)
Essas duas espécies contribuem para a formação da chuva ácida.
Leia também: Conteúdos de Biologia que mais caem no Enem
→ Soluções
Soluções são misturas homogêneas compostas por um ou mais solutos diferentes dissolvidos em um solvente. Dentro do âmbito do estudo de soluções, merecem atenção os conteúdos de solubilidade, diluições e titulações. Ainda, é importante dominar as unidades de concentração, sabendo aplicar os conceitos de molaridade, densidade, massa molar e expressão de concentração em porcentagem.
Questões envolvendo conceitos de soluções têm aparecido com frequência no Enem. Veja um exemplo de questão que engloba conceitos de molaridade, densidade e concentração a seguir.
(Enem) O soro fisiológico é uma solução aquosa de cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e de lentes de contato. Sua concentração é 0,90% em massa e densidade igual a 1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à água para preparar 500 mL desse soro?
A) 0,45
B) 0,90
C) 4,50
D) 9,00
E) 45,00
Resolução:
Alternativa C
A concentração da solução de soro é dada em porcentagem massa/massa, e é igual a 0,90% (equivalente a 0,009). A concentração de uma solução é a relação entre a massa do soluto e a massa do solvente.
\(\mathbf{concentração=\frac{massa\ de\ NaCl}{massa\ da\ solução}=0,009}\)
Para preparar um volume de 500 mL da solução de soro, utiliza-se a informação de densidade e se calcula a massa da solução:
\(\mathbf{1\ g—1\ mL}\)
\(\mathbf{x—500\ mL}\)
\(\mathbf{x=500\ g\ de\ solução}\)
Então, conhecendo a massa da solução e substituindo na relação de concentração, tem-se:
\(\mathbf{\frac{massa\ de\ NaCl}{500\ g}=0,009}\)
\(\mathbf{massa\ de\ NaCl=4,5\ g}\)
A massa de NaCl para preparar 500 mL de soro em concentração de 0,90% é de 4,5 g.
Importante: Considerando o cenário de pandemia de covid-19 vivido, o uso do álcool como agente de desinfecção pode ser abordado na prova de Química, explorando os conceitos de concentração, diluição e densidade.
→ Equilíbrio químico
Equilíbrio químico é uma condição alcançada por reações químicas reversíveis, em que as reações direta e inversa alcançam a mesma velocidade, ou seja, os produtos e os reagentes estão sendo formados e consumidos com a mesma taxa.
Dentro desse assunto, é primordial reconhecer os fatores que afetam a posição de equilíbrio e como eles agem (deslocamento do equilíbrio). A condição de equilíbrio químico de um sistema pode ser alterada pela variação de concentração, alteração de temperatura e pressão (para gases) e ação de catalisadores, seguindo o princípio de Le Chatelier.
Ainda dentro desse assunto, é importante entender sobre as constantes de equilíbrio, especialmente a constante de ionização. Veja como esse tema já foi abordado no Enem a seguir.
(Enem) Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
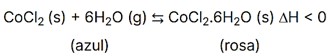
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
A) Resfriaria no congelador.
B) Borrifaria com spray de água.
C) Envolveria com papel alumínio.
D) Aqueceria com secador de cabelos.
E) Embrulharia em guardanapo de papel.
Resolução:
Alternativa D
Perceba que o sal de cobalto apresenta cor azul quando seco e se torna rosa quando está úmido (associado à água). A reação informa que a variação de entalpia da reação direta é negativa, ou seja, é um processo exotérmico (libera energia).
Para que um cartão que já estivesse rosa (úmido) volte a ficar azul (seco), é necessário deslocar a reação no sentido dos reagentes. Para isso, entre as opções apresentadas, o ideal é aquecer o cartão com secador de cabelos. Como se sabe que a reação é exotérmica no sentido direto, ela será endotérmica no sentido inverso, sendo os reagentes favorecidos quando o sistema é aquecido.
Acesse também: O que mais cai no Enem em todas as disciplinas?
Outros conteúdos importantes de Química que também podem cair no Enem
Outros temas que valem a pena estudar e que aparecem com regularidade nas provas do Enem são a Tabela Periódica e suas propriedades, os modelos atômicos e a distribuição eletrônica, as ligações químicas, e a geometria molecular. Conceitos de radioatividade e de reações nucleares podem ser abordados na prova, considerando as tensões geopolíticas mundiais atuais.
Crédito de imagem
Brenda Rocha – Blossom / Shutterstock
Por Ana Luiza Lorenzen Lima
Professora de Química
[ad_2]
Fonte




